- Εκδήλωση για τον Α' Παγκόσμιο Πόλεμο 17/3/2024
- Ecomobility 17/3/2024
- Σεμινάριο Πρώτων Βοηθειών από το ΕΚΑΒ 14/3/2025
- Εκδήλωση με θέμα "Βυζαντινή Μουσική και Αγιογραφία" 12/3/2025
- Ενημέρωση και επίδειξη από το ΚΕΠΕΑ Στυλίδας - Υπάτης 5/3/2024
- Γλέντι Τσικνοπέμπτης 20/2/2025
- Ενημέρωση από Γεωπόνο σχετικά με τις καλλιέργειες 19/2/2024
- Ενημέρωση και επίδειξη παροχής Πρώτων Βοηθειών από το ΕΚΑΒ 18/2/2024
- Παρακολούθηση της παρασκευής πρόσφορου και προζυμιού 17/2/2024
- Επίσκεψη σε κατάστημα παρασκευής σαπουνιών 29/1/2025
- Κοπή Βασιλόπιτας 28/1/2025
- Συμμετοχή στην εκδήλωση "Κύπρος: 50 χρόνια από την Τουρκική εισβολή" 23/1/2025
- Συμμετοχή στη Διημερίδα "Διαδικτυακές προκλήσεις και πρακτικές αντιμετώπισης" 16/1/2025
- Συμμετοχή στις δράσεις του Πειρ. ΣΑΕΚ Λαμίας 19/12/2024
- Συμμετοχή στο 7ο Φεστιβάλ Ψυχικής Υγείας 13/12/2024
- Ενημερωτική Εκδήλωση - Συζήτηση για τη Ψυχική Υγεία 12/12/2024
- Παραλαβή Πιστοποιητικών Ελληνομάθειας Επιτυχόντων στις Εξετάσεις 2024
ΣΔΕ ΛΑΜΙΑΣ - ΗΛΕΚΤΡΟΝΙΚΗ ΤΑΞΗ : ΦΥΣΙΚΕΣ ΕΠΙΣΤΗΜΕΣ (ΧΗΜΕΙΑ)
ΕΒΔΟΜΑΔΑ : 16-20/11/2020
Άτομα - Μόρια - Περιοδικός Πίνακας Στοιχείων -
Ονοματολογία Ανόργανων Χημ. Ενώσεων
Μπατζάκας Δημήτρης (Δ/ντης)
ΘΕΩΡΙΑ : ΕΝΝΟΙΕΣ - ΠΙΝΑΚΕΣ
IONTA
Κάτω από ορισμένες συνθήκες, τα άτομα παίρνουν ή χάνουν ηλεκτρόνια και μετατρέπονται σε φορτισμένα σωματίδια που ονομάζονται ιόντα. Όταν ένα άτομο πάρει ηλ/ναι, μετατρέπεται σε αρνητικό ιόν το ανιόν, ενώ όταν χάσει ηλεκτρόνια μετατρέπεται σε θετικό ιόν, το κατιόν.
Υπάρχουν απλά ιόντα (των ατόμων) και πολυατομικά ιόντα που συμπεριφέρονται σαν άτομα (συγκροτήματα ατόμων ? ρίζες)
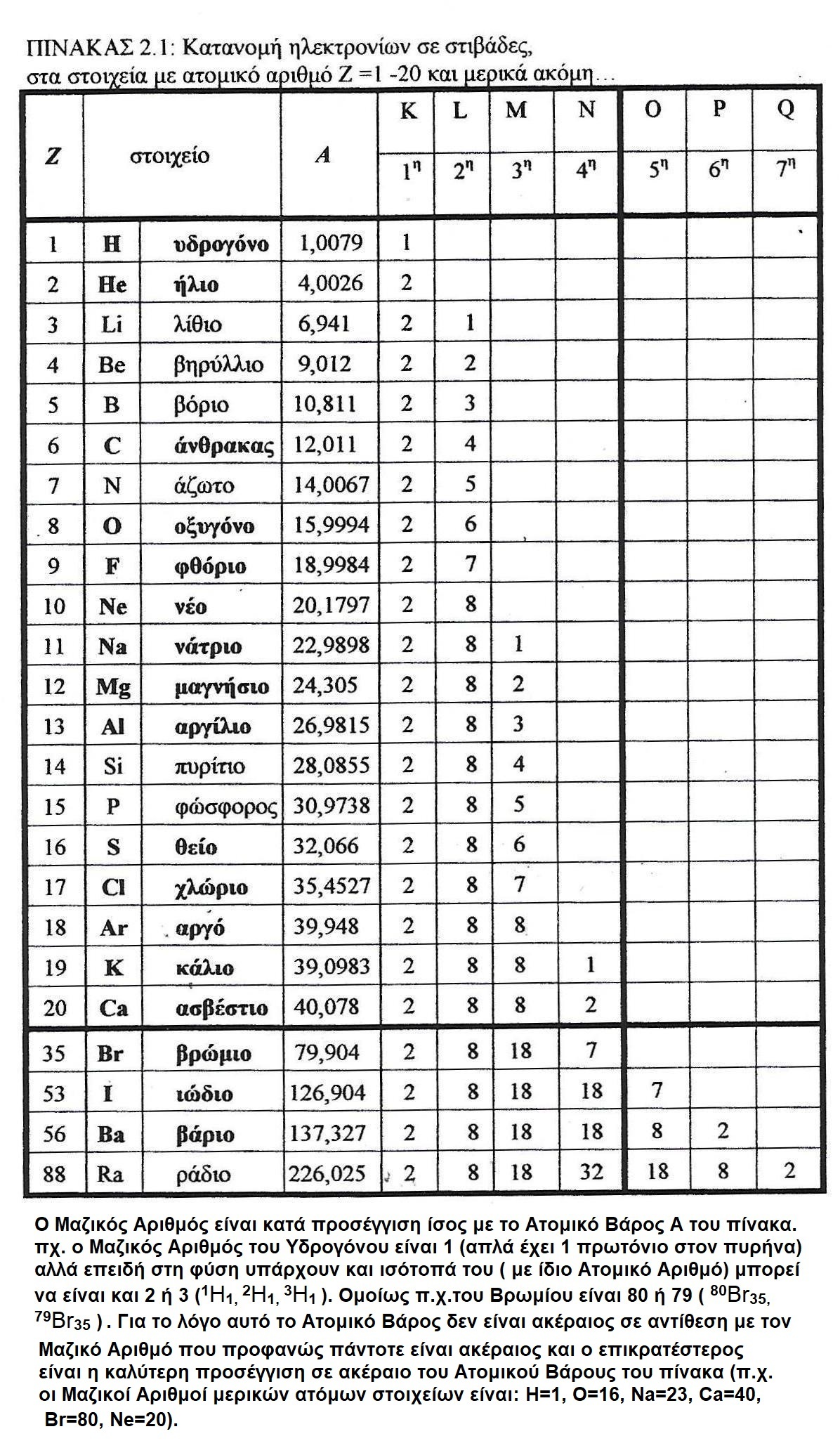
Βλέπε πίνακες 2.3, 2.4, 2.5
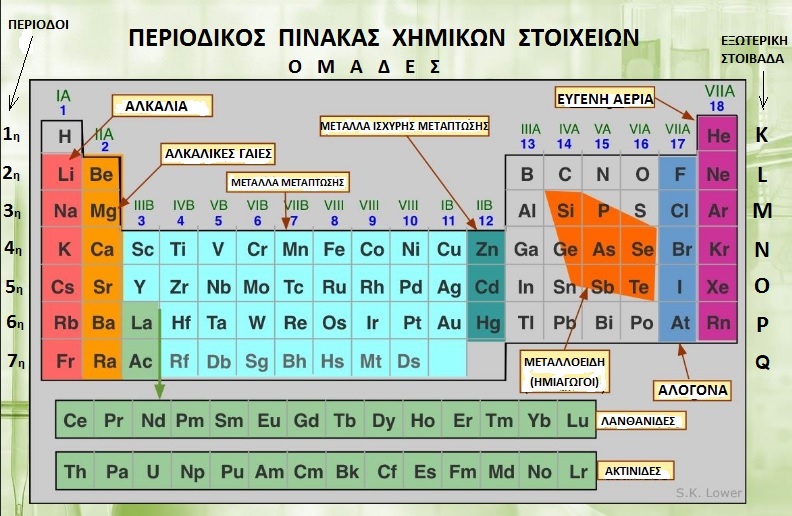
ΣΥΜΒΟΛΑ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ (ΣΥΝΗΘΕΣΤΕΡΑ)
|
Όνομα-Χημ. σύμβολο |
Όνομα-Χημ. σύμβολο |
Όνομα-Χημ. σύμβολο |
|
Άνθρακας C |
Κάλιο K |
Πυρίτιο Si |
|
Αργίλιο Al |
Κασσίτερος Sn |
Σίδηρος Fe |
|
Αργό Ar |
Κρυπτό Kr |
Υδράργυρος Hg |
|
Αρσενικό As |
Λευκόχρυσος Pt |
Υδρογόνο H |
|
Ασβέστιο Ca |
Λίθιο Li |
Φθόριο F |
|
Βάριο Ba |
Μαγγάνιο Mn |
Φωσφόρος P |
|
Βισμούθιο Bi |
Μαγνήσιο Mg |
Χαλκός Cu |
|
Βρώμιο Br |
Μόλυβδος Pb |
Χλώριο Cl |
|
Γερμάνιο Ge |
Νάτριο Na |
Χρυσός Au |
|
ΉλιοHe |
Νέον Ne |
Χρώμιο Cr |
|
ΘείοS |
Νικέλιο Ni |
Ψευδάργυρος Zn |
|
ΙώδιοI |
Ξένο Xe |
|
|
Κάδμιο Cd |
Οξυγόνο O |
Αν αριθμήσετε σε οριζόντιες σειρές τα στοιχεία όπως είναι διατεταγμένα έχετε τον ατομικό αριθμό τους Ζ (π.χ. το Αr βρίσκεται στη θέση 18 οπότε Ζ=18)
Δεν ξεχνάμε ότι:
- Ζ είναι ο ατομικός αριθμός του ατόμου και ισούται με τον αριθμό των (θετικών ηλ. φορτίων) πρωτονίων του πυρήνα όπως και με τον αριθμό των (αρνητικών ηλ. φορτίων) ηλεκτρονίων στις στοιβάδες γύρω απ? τον πυρήνα (στα ηλεκτρικά ουδέτερα άτομα) και είναι ο αύξων αριθμός κατάταξης των στοιχείων στον περιοδικό πίνακα.
- Α είναι το Ατομικό Βάρος, δηλ. η μάζα του ατόμου και επειδή είναι συγκεντρωμένη στον πυρήνα (η μάζα των ηλεκτρονίων είναι αμελητέα) ισούται κατά προσέγγιση (λόγω ύπαρξης ισοτόπων) με τον Μαζικό Αριθμό Α=Ζ+Ν (Ν = ο αριθμός των ηλ. ουδετέρων νετρονίων του πυρήνα).
- Φορτίο ηλεκτρονίου = φορτίο πρωτονίου (σε απόλυτη τιμή).
- Μάζα πρωτονίου = μάζα νετρονίου = 1820 φορές τη μάζα του ηλεκτρονίου.
- Τα άτομα των στοιχείων (Σ) συνήθως δίνονται με τη μορφή ΑΣΖ και των ισοτόπων τους Α1ΣΖ , Α2ΣΖ , ?. κ.ο.κ.
- Ομέγιστοςαριθμός ηλεκτρονίων κάθε στοιβάδας είναι 1η - Κ: 2e , 2η - L: 8e , 3η - M:18e, 4η - N: 32e?.. Hεξωτερική στοιβάδα έχει μέχρι 8eκαι ισχύει ο κανόνας της οκτάδας όπου κάθε άτομο, αλληλεπιδρώντας με άλλα άτομα, επιδιώκει να συμπληρώσει την εξωτερική του στοιβάδα με 8e όπως τα αδρανή ευγενή αέρια (πλην της 1ης που συμπληρώνεται με 2e).
- Οξέα είναι οι χημικές ενώσεις με κατιόν Η+ (αριστερά), βάσεις όσες έχουν ανιόν ΟΗ- (δεξιά), οξείδια όσες έχουν ανιόν Ο-2 (δεξιά) και άλατα συνήθως όσες δεν έχουν τίποτε από τα παραπάνω (πλην εξαιρέσεων όπως υδρίδια, καρβίδια κ.α.) και τα ονόματά τους ξεκινούν από το όνομα του ανιόντος πλην των υδραλογόνων (βλ. Περιοδικό Πίνακα για αλογόνα) και του υδρόθειου.
ΠΙΝΑΚΑΣ 2.3: Ονοματολογία των κυριότερων μονοατομικών ιόντων
|
Cl- χλωριούχο ή χλωρίδιο |
O2- οξυγονούχο ή οξείδιο |
|
Br- βρωμιούχο ή βρωμίδιο |
S2- θειούχο ή σουλφίδιο |
|
I- ιωδιούχο ή ιωδίδιο |
Ν3- αζωτούχο ή νιτρίδιο |
|
F- φθοριούχο ή φθορίδιο |
P3- φωσφορούχο ή φωσφίδιο |
|
Η- υδρογονούχο ή υδρίδιο (ή οξύ) |
ΗS- όξινο θειούχο |
|
CN- κυάνιο (κυανιούχο ή κυανίδιο) |
ΠΙΝΑΚΑΣ 2.4: Ονοματολογία των κυριότερων πολυατομικών ιόντων
|
NO3-1 νιτρικό |
CN-1 κυάνιο (κυανίδιο) |
HCO3-1 όξινο ανθρακικό |
|
NO2-1 νιτρώδες |
ΡΟ33- φωσφορώδες |
HPO42- όξινο φωσφορικό |
|
CO32- ανθρακικό |
ClO4-1 υπερχλωρικό |
Η2PO4-1 δισόξινο φωσφορικό |
|
SO42- θειικό |
ClO3-1 χλωρικό |
AlO3- αργιλικό |
|
SO3-2 θειώδες |
HSO3-1 όξινο θειώδες |
ΜnO2-1 μαγγανικό |
|
ΡΟ43- φωσφορικό |
ClO2-1 χλωριώδες |
ΜnO4-1 υπερμαγγανικό |
|
OH-1 υδροξείδιο |
ClO-1 υποχλωριώδες |
Cr2O72- διχρωμικό |
|
ΝΗ4+1 αμμώνιο |
HSO4-1 όξινο θειικό |
CrO42- χρωμικό |
ΠΙΝΑΚΑΣ 2.5: Συνήθεις τιμές Α. Ο. (αριθ. Οξείδωσης) στοιχείων σε ενώσεις τους.
Σημείωση: ο Α.Ο. αναφέρεται πολλές φορές και με τον όρο «σθένος» οπότε π.χ. τα Κ,Η,F είναι μονοσθενή, τα Ba,Ca, O δισθενή και τα Al,Cr τρισθενή.
|
Μέταλλα |
Αμέταλλα |
||
|
Κ, Na, Ag |
+ 1 |
F |
-1 |
|
Ba, Ca, Mg, Zn |
+2 |
H |
+1 (-1) |
|
A1 |
+3 |
Ο |
-2(-1,+2) |
|
Cu, Hg |
+ 1,+2 |
CI, Br, I |
-1(+1, +3, +5, +7) |
|
Fe, Ni |
+2, +3 |
S |
-2 (+4, +6) |
|
Pb, Sn |
+2,+4 |
Ν, Ρ |
-3 (+3, +5) |
|
Mn |
+2, +4, +7 |
C, Si |
-4,+4 |
|
Cr |
+3, +6 |
||
Ερωτήσεις Σωστού ? Λάθους (Σ ? Λ )
- Τα μόρια των χημικών ενώσεων αποτελούνται από το ίδιο είδος ατόμων
Σωστό
Λάθο
2. Το μόριο ενός χημικού στοιχείου μπορεί να αποτελείται και από διαφορετικά είδη ατόμων
Σωστό
Λάθος
3. Τα πολυατομικά ιόντα (χημικές ρίζες) συμπεριφέρονται σαν άτομα και μπορούν να αποτελούνται και από το ίδιο είδος ατόμων
Σωστό
Λάθος
4. Για κάθε στοιχείο ο Μαζικός Αριθμός του ατόμου του μπορεί να παίρνει διαφορετικές τιμές ενώ ο Ατομικός Αριθμός του ποτέ δεν αλλάζει
Σωστό
Λάθος
5. Τα πρωτόνια και τα νετρόνια έχουν ίδιο ηλ. φορτίο (σε απόλυτη τιμή)
Σωστό
Λάθος
6. Τα ηλεκτρόνια και τα πρωτόνια έχουν ίδια μάζα
Σωστό
Λάθος
7. Κάθε άτομο αποτελείται από τον πυρήνα με πρωτόνια και ηλεκτρόνια και από τις εξωτερικές στοιβάδες στις οποίες περιφέρονται τα νετρόνια
Σωστό
Λάθος
8. Τα άτομα των στοιχείων Η, Κ, Hg εύκολα μετατρέπονται σε κατιόντα, Η+1, Κ+1, Μg+2 οπότε είναι μέταλλα
Σωστό
Λάθος
Ερωτήσεις πολλαπλής επιλογής
Στις παρακάτω ερωτήσεις να βάλετε σε κύκλο το γράμμα που αντιστοιχεί στη σωστή απάντηση.
- Η εξωτερική στιβάδα του ατόμου ενός στοιχείου Σ έχει 7 ηλεκτρόνια. Ο ατομικός αριθμός αυτού του στοιχείου μπορεί να είναι:
α. 7
β. 8
γ. 9
δ. 17
2. Η εξωτερική στιβάδα του ατόμου ενός στοιχείου Ψ έχει 4 ηλεκτρόνια. Ο ατομικός αριθμός του στοιχείου Ψ δε μπορεί να είναι:
α. 4
β. 6
γ. 14
δ. 20
3. Η ακριβής θέση ενός στοιχείου στον περιοδικό πίνακα καθορίζεται από:
α. το ατομικό του βάρος
β. τον μαζικό του αριθμό
γ. τον ατομικό του αριθμό
δ. τον αριθμό των ηλεκτρονίων της εξωτερικής του στιβάδας
ε. από άλλους παράγοντες
4. Δίνονται τα σύμβολα των 18 πρώτων στοιχείων του Περιοδικού Πίνακα κατά σειρά αυξανόμενου ατομικού αριθμού: H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, AL, Si, P, S, CL, Ar.
i) Ένα δισθενές κατιόν και ένα μονοσθενές ανιόν που έχουν τον ίδιο αριθμό ηλεκτρονίων με το Νe είναι:
α. το Be+2 και το F-1
β. το S-2και το Na+1
γ. το Ca+2και το CL-1
δ. το Mg+2και το F-1
ii) Τα στοιχεία αυτά είναι τοποθετημένα στον περιοδικό πίνακα:
α. σε τρεις περιόδους και σε εννιά ομάδες
β. σε τρεις ομάδες και σεοχτώ περιόδους
γ. σε δύο ομάδες και σε εννιά περιόδους
δ. σε τρεις ομάδες και σε οχτώ περιόδους
5. Στο άτομο στοιχείου, όταν μετατρέπεται σε ιόν, υφίστανται οι εξής αλλαγές:
α. αλλάζει ο ατομικός του αριθμός
β. αλλάζει ο μαζικός του αριθμός
γ. αλλάζει ο αριθμός των ηλεκτρονίων του
δ. τίποτα από τα παραπάνω
ΕΡΓΑΣΙΕΣ - ΑΣΚΗΣΕΙΣ
Α.
Δίνονται οι ηλεκτρονιακές δομές των παρακάτω ουδέτερων ατόμων των στοιχείων Σ1, Σ2, Σ3, Σ4, Σ5, Σ6. Να βρεθούν με τη βοήθεια του πίνακα 2.1:
- Ποια είναι τα στοιχεία (ταυτότητα)
- Η δομή των πυρήνων τους
- Ποια είναι τα πιθανότερα ιόντα τους
- Ποια στοιχεία μπορούν ανά δύο να σχηματίσουν χημική ένωση με ιοντικούς δεσμούς (πολικούς ή ημιπολικούς με ηλεκτροστατικές δυνάμεις έλξης). Να γραφούν οι χημικοί τύποι των πιθανών χημικών ενώσεων και τα ονόματά τους
Β.
Να συμπληρωθεί ο παρακάτω πίνακας με τη βοήθεια των πινάκων 2.3, 2.4, 2.5 και των κατηγοριών: οξύ, βάση, άλας, όξινο οξείδιο (αμετάλλου) βασικό οξείδιο (μετάλλου)
|
α/α |
Χημικός τύπος |
Ονομασία |
Κατηγορία |
|
1 |
Na2SO4 |
||
|
2 |
Fe(OH)2 |
||
|
3 |
H2SO4 |
||
|
4 |
Na2O |
||
|
5 |
(NH4)2CO3 |
||
|
6 |
KOH |
||
|
7 |
Θειικό αργίλιο |
||
|
8 |
Βρωμιούχο κάλιο |
||
|
9 |
Όξινο φωσφορικό αμμώνιο |
||
|
10 |
Οξείδιο του μαγνησίου |
||
|
11 |
Υδροχλώριο |
||
|
12 |
CO2 |
||
|
13 |
HCN |
||
|
14 |
HNO3 |
||
|
15 |
BaBr2 |
||
|
16 |
CaS |
||
|
17 |
Ιωδιούχος άργυρος |
||
|
18 |
Υδροξείδιο του νατρίου |
||
|
19 |
Μονοξείδιο του αζώτου |
||
|
20 |
Χλωριούχος άργυρος |
Καλή επιτυχία .. !!!
Απαντήσεις: Σε χαρτί στο σχολείο ή στο email: Αυτή η διεύθυνση ηλεκτρονικού ταχυδρομείου προστατεύεται από τους αυτοματισμούς αποστολέων ανεπιθύμητων μηνυμάτων. Χρειάζεται να ενεργοποιήσετε τη JavaScript για να μπορέσετε να τη δείτε.


